Potencjalna antygenowa reaktywność krzyżowa pomiędzy SARS-CoV-2 i tkankami ludzkimi a choroby autoimmunologiczne
Źródło: Clinical Immunology Volume 217, August 2020, 108480; Potential antigenic cross-reactivity between SARS-CoV-2 and human tissue with a possible link to an increase in autoimmune diseases

Potencjalna antygenowa reaktywność krzyżowa pomiędzy SARS-CoV-2 i tkankami ludzkimi a choroby autoimmunologiczne
Od czasu wybuchu epidemii COVID-19 wywołanej przez SARS-CoV-2, przebadaliśmy 5 różnych próbek krwi, w których potwierdzono dodatni wynik na obecność przeciwciał IgG i IgM przeciwko SARS-CoV-2[1]. Pomiary dotyczyły przeciwciał przeciwjądrowych (ANA), przeciwciał przeciwko ekstrakcyjnemu antygenowi jądrowemu (ENA), przeciwko dwuniciowemu DNA (dsDNA), przeciwciał aktyny, przeciwciał mitochondrialnych, czynnika reumatoidalnego (RF) i kompleksów immunologicznych C1q. Byliśmy zaskoczeni, gdy odkryliśmy, że 3 z 5 próbek miały znacząco podwyższone przeciwciała ANA, ENA, przeciw aktynowe i mitochondrialne, ale nie przeciwko dsDNA i RF. Skłoniło nas to do zbadania wzorców reaktywności krzyżowej pomiędzy SARS-CoV-2 a docelowymi białkami autoimmunologicznymi.
Wywołana szczepionką autoagresja z autoimmunologicznej reaktywności krzyżowej jest związana z narkolepsją, zespołem Guillain-Barrégo, stwardnieniem rozsianym, neuropatiami demielinizacyjnymi, toczniem rumieniowatym układowym i zespołem posturalnej tachykardii ortostatycznej w podatnych podgrupach, jak donoszą Segal i Shoenfeld[2]. Ze względu na znaczące sygnały ostrzegawcze dla potencjalnych interakcji krzyżowych z obecną pandemią COVID-19, badaliśmy zależności pomiędzy białkami kolca i tymi występującymi w jądrze SARS-CoV-2 a docelowymi białkami autoimmunologicznymi.
Komercyjnie dostępne mysie przeciwciało monoklonalne stworzone przeciwko rekombinowanemu białku kolca koronawirusa SARS i królicze przeciwciało monoklonalne stworzone przeciwko nukleoproteinie koronawirusa SARS zostały zastosowane w optymalnym roztworze dla białek SARS-CoV-2 i 50 różnych antygenów tkankowych przy użyciu metody immunosorpcji skoniugowanych enzymów (ELISA). Rekombinowane białko kolcowe SARS-CoV-2 S1 i rekombinowane białko nukleokapsydu SARS-CoV-2 zakupiono od firmy RayBiotech. Płytki dołkowe do testu ELISA były pokryte antygenami jądrowymi, dsDNA, aktyną F i antygenem mitochondrialnym (M2) zakupionymi od różnych firm. Dodatkowe 45 antygenów tkankowych użytych w tym badaniu zostało wcześniej opisanych[9]. Każde przeciwciało SARS-CoV-2 było aplikowane do czterodołkowych płytek. Po zakończeniu wszystkich etapów testu ELISA, rozwiniętą barwę mierzono przy długości fali 405 nm.
Patrząc na reakcję między przeciwciałem przeciw białku kolca SARS-CoV-2 a białkami tkankowymi (Ryc. 1A), stwierdziliśmy, że najsilniejsze reakcje zachodziły z transglutaminazą 3 (tTG3), transglutaminazą 2 (tTG2), ENA, zasadowym białkiem mieliny (MBP), mitochondriami, antygenem jądrowym (NA), α-miozyną, peroksydazą tarczycową (TPO), kolagenem, klaudyną 5+6 i białkiem S100B. Reakcja tego przeciwciała nie była tak silna z kilkoma innymi antygenami (Ryc. 1A).
Ryc. 1. (A) Reakcja przeciwciała monoklonalnego przeciwko białku kolca SARS-CoV-2 z ludzkimi antygenami tkankowymi. (B) Reakcja przeciwciała monoklonalnego przeciw nukleoproteinie SARS-CoV-2 z ludzkimi antygenami tkankowymi.
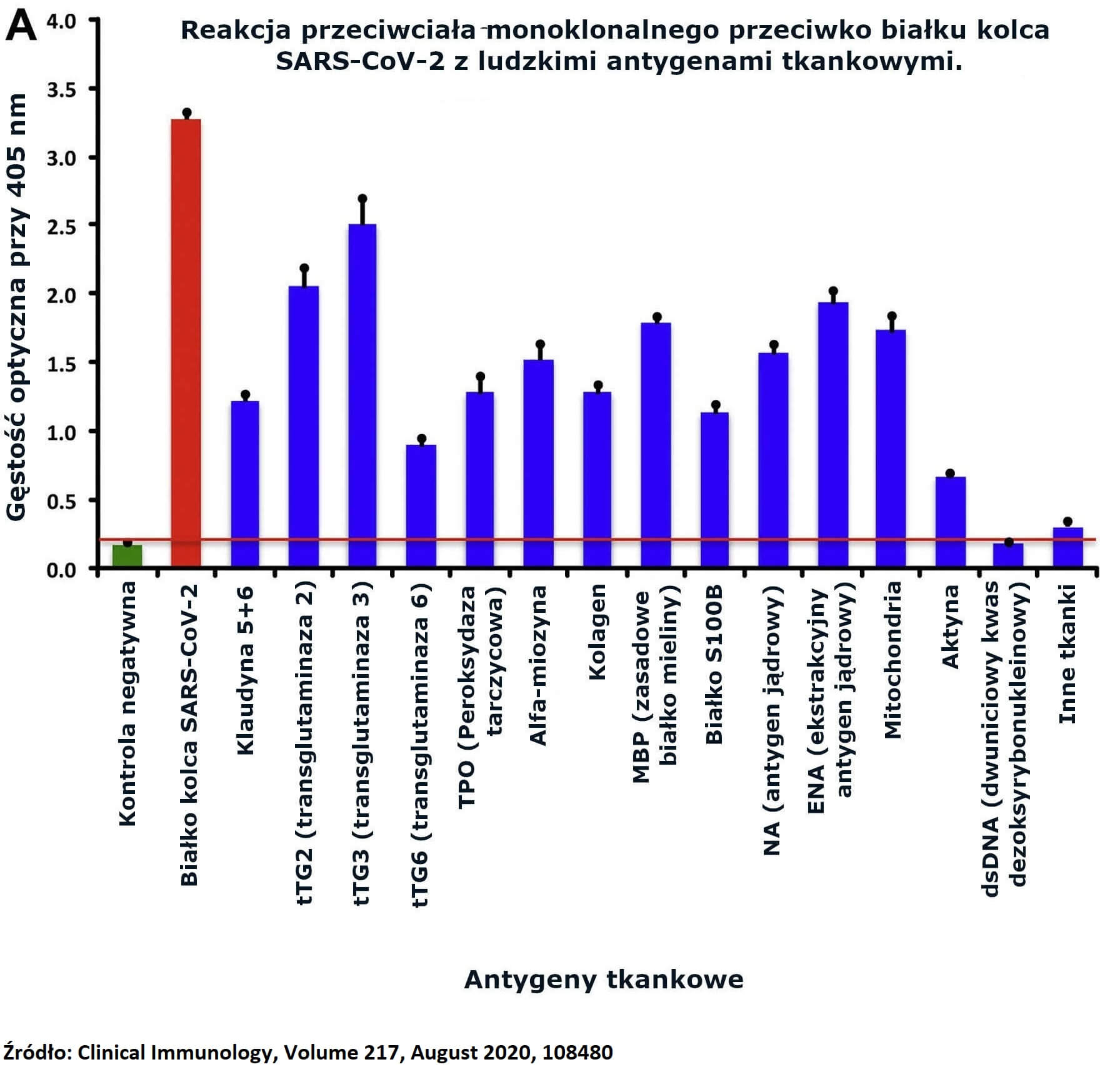
(A) Reakcja przeciwciała monoklonalnego przeciwko białku kolca SARS-CoV-2 z ludzkimi antygenami tkankowymi.
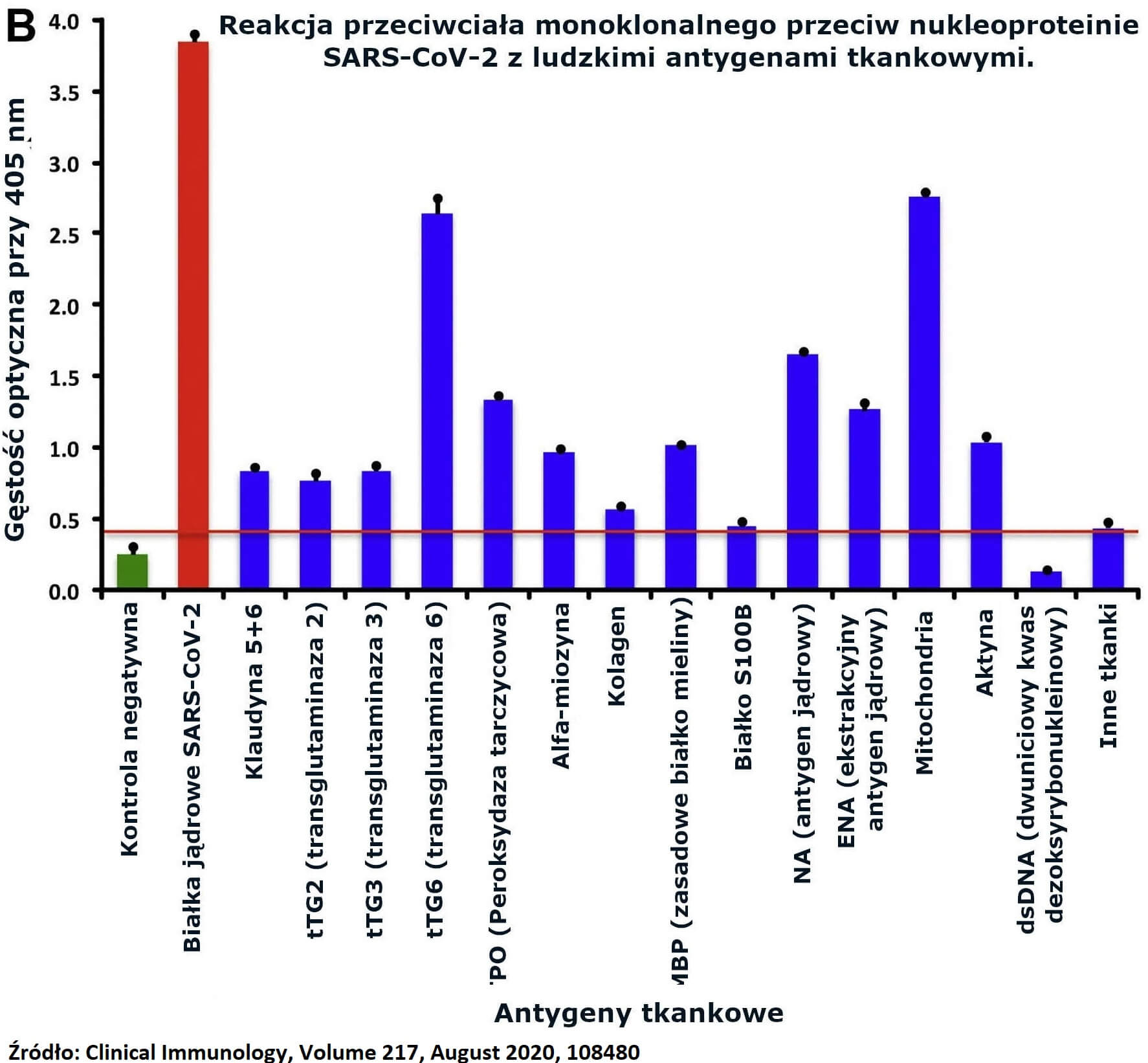
B) Reakcja przeciwciała monoklonalnego przeciw nukleoproteinie SARS-CoV-2 z ludzkimi antygenami tkankowymi.
Przeciwciało nukleoproteinowe wykazywało pewną immunologiczną reaktywność krzyżową z przeciwciałem przeciwko białku kolca. Jak pokazano na Ryc. 1B, przeciwciało nukleoproteinowe reagowało silnie z mitochondriami, tTG6, NA, TPO, ENA, TG, aktyną i MBP. Podobnie jak w przypadku białka kolca, reakcja przeciwciała nukleoproteinowego nie była tak silna z kilkoma innymi antygenami, jak pokazano na Ryc. 1A i B.
W miarę jak liczba zakażeń SARS-CoV-2 wzrasta z dnia na dzień, naukowcy dowiadują się, że szkody wyrządzane przez tego wirusa mogą wykraczać daleko poza płuca, gdzie zakażenie może prowadzić do zapalenia płuc i często powodującego śmierć stanu zwanego zespołem ostrej niewydolności oddechowej[3]. Wirus może w rzeczywistości wpływać na organizm od stóp do głów, w tym na układ nerwowy[4], sercowo-naczyniowy[5], odpornościowy[6] i pokarmowy[7].
Czy jest możliwe, że niektóre z rozległych uszkodzeń narządów, tkanek i komórek spowodowanych przez SARS-CoV-2 są wynikiem mimikry antygenowej wirusa z tkankami ludzkimi?
Jeśli odpowiedź jest twierdząca, to w przyszłości możemy stanąć w obliczu wzrostu liczby zachorowań na choroby autoimmunologiczne, ponieważ każdy czynnik, który powoduje przewlekły stan zapalny w organizmie, może potencjalnie wywołać chorobę autoimmunologiczną.
Ponieważ SARS-CoV-2 atakuje najpierw układ oddechowy, w bardzo interesującym artykule[8] Kanduc i Shoenfeld zasugerowali, że z powodu tego, iż glikoproteina kolca SARS-CoV-2 i białka surfaktantu płucnego mają wspólne 13 z 24 pentapeptydów, reakcja odpornościowa po zakażeniu SARS-CoV-2 może prowadzić do reakcji krzyżowych z białkami surfaktantu płucnego, a następnie do choroby płuc związanej z SARS-CoV-2[8]. W oparciu o swoje odkrycia przestrzegali przed stosowaniem w szczepionkach całych antygenów SARS-CoV-2 i pouczali o tym, że być może najskuteczniejszym sposobem zwalczania zakażenia SARS-CoV-2 będzie użycie jedynie unikalnych peptydów. Bardzo podobne sugestie wysunęli Razim i in., projektując szczepionkę przeciwko Clostridium difficile[9]. Dwie sekwencje, peptyd 9 i peptyd 10 C. difficile były rozpoznawane nie tylko przez surowice pacjentów z zakażeniami C. difficile, ale także przez surowice pacjentów z chorobą autoimmunologiczną. Razim i in. doszli do wniosku, że przed rozważeniem białka jako antygenu szczepionkowego należy zwrócić szczególną uwagę na analizę sekwencji tkankowych epitopów reagujących krzyżowo, aby uniknąć ewentualnych skutków ubocznych w przyszłości[9].
Dr Peter McCullough o blokowaniu metod leczenia Covid-19
Leczenie chorób wirusowych: czy prawdę ukrywano przez dziesięciolecia? – dr Lee D. Merritt
Zgadzamy się z Razimem i in. i uważamy, że nasze własne odkrycia dotyczące tego, że 21 z 50 antygenów tkankowych reagowało umiarkowanie lub silnie z przeciwciałami SARS-CoV-2, są wystarczająco silnym wskazaniem na reakcje krzyżowe między białkami SARS-CoV-2 i różnymi antygenami tkankowymi poza tkanką płucną, co może prowadzić do autoagresji przeciwko tkance łącznej oraz układowi sercowo-naczyniowemu, pokarmowemu i nerwowemu.
Żyjemy w krytycznych czasach, w których świat może zmierzać w kierunku bardzo realnej możliwości wprowadzenia wymogu posiadania „paszportów” poświadczających odporność, uzyskanych w wyniku uprzedniego zakażenia SARS-CoV-2 lub szczepienia, przed dopuszczeniem do podróży, a być może nawet do pracy[10].
Dziesięć powodów, dla których paszporty odpornościowe to zły pomysł
Dyskryminujące paszporty [szczepionkowe] – Nigdy Więcej – Sam Wald
Patogeny i polityka: dalsze dowody, że występowanie pasożytów zapowiada autorytaryzm
W chwili obecnej naukowcy gorączkowo próbują opracować ostateczne lekarstwo, przeciwciała neutralizujące lub szczepionkę, która przede wszystkim uchroniłaby nas przed zarażeniem się chorobą, i chcą tego dokonać już teraz. Musimy wziąć pod uwagę, że znalezienie szczepionki na daną chorobę w normalnej sytuacji może zająć lata. Istnieją powody dla wszystkich środków ostrożności związanych z opracowaniem szczepionki, z których nie najmniej ważnym są niepożądane skutki uboczne. W świetle omówionych powyżej informacji na temat reaktywności krzyżowej białek SARS-CoV-2 z tkankami ludzkimi oraz możliwości wywołania autoagresji, zaostrzenia już i tak niebezpiecznych chorób lub innych nieprzewidzianych konsekwencji, rozsądne byłoby przeprowadzenie szerzej zakrojonych badań dotyczących zdolności antygenów SARS-CoV-2 do wywoływania autoagresji. Promowanie i wdrażanie na całym świecie tak agresywnego programu „paszportów szczepionkowych” przy braku dokładnych i skrupulatnych badań dotyczących bezpieczeństwa może spowodować poniesienie przez ludzkość ogromnych kosztów w postaci kolejnej epidemii, tym razem wzbierającej fali wzmożonych chorób autoimmunologicznych i związanych z nimi latami cierpień.
Przypisy:
1. J.D. Whitman, J. Hiatt, C.T. Mowery, B.R. Shy, R. Yu, T.N. Yamamoto, et al.
Test performance evaluation of SARS-CoV-2 serological assay
MedRxiv (2020), 10.1101/2020.04.25.20074856
[2] Y. Segal, Y. Shoenfeld
Vaccine-induced autoimmunity: the role of molecular mimicry and immune crossreaction
Cell Mol. Immunol., 15 (6) (2018), pp. 586-594, 10.1038/cmi.2017.151
[3] P. Zhou, X.-L. Yang, X.-G. Wang, B. Hu, L. Zhang, W. Zhang, et al.
A pneumonia outbreak associated with a new coronavirus of probable bat origin
Nature, 579 (7798) (2020), pp. 270-273, 10.1038/s41586-020-2012-7
[4] A. Nath
Neurologic complications of coronavirus infections
Neurology, 94 (19) (2020), pp. 809-810, 10.1212/WNL.0000000000009455
[5] Y.-Y. Zheng, Y.-T. Ma, J.-Y. Zhang, X. Xie
COVID-19 and the cardiovascular system
Nat. Rev. Cardiol., 17 (5) (2020), pp. 259-260, 10.1038/s41569-020-0360-5
[6] Y. Shi, Y. Wang, C. Shao, J. Huang, J. Gan, X. Huang, et al.
COVID-19 infection: the perspectives on immune responses
Cell Death Different., 27 (2020), pp. 1451-1454, 10.1038/s41418-020-0530-3
[7] L. Lin, X. Jiang, Z. Zhang, S. Huang, Z. Zhang, Z. Fang, et al.
Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection
Gut, 69 (6) (2020), pp. 997-1001, 10.1136/gutjnl-2020-321013
[8] D. Kanduc, Y. Shoenfeld
On the molecular determinants of the SARS-CoV-2 attack
Clin. Immunol., 215 (2020), p. 108426, 10.1016/j.clim.2020.108426
[9] A. Razim, K. Pacyga, M. Aptekorz, G. Martirosian, A. Szuba, E. Pawlak-Adamska, et al.
Epitopes identified in GADPH from Clostridium difficile recognized as common antigens with potential autoimmunizing properties
Sci. Rep., 8 (1) (2018), p. 13946, 10.1038/s41598-018-32193-9
[10] M.A. Hall, D.M. Studdert
Privileges and immunity certification during the COVID-19 pandemic
JAMA (2020 May 6), 10.1001/jama.2020.7712

